卢曾军教授团队首次发现E3泛素连接酶RNF144B调控抗病毒天然免疫的新机制
近日,兰州大学动物医学与生物安全学院卢曾军教授团队以 “RNF144B negatively regulates antiviral immunity through targeting MDA5 for autophagic degradation” 为题在《EMBO Reports》发表研究成果,首次发现了E3泛素连接酶RNF144B能够通过促进MDA5的K23与K43位泛素化修饰,进而诱导其通过自噬途径降解,从而负向调控I型干扰素信号通路,促进病毒复制。
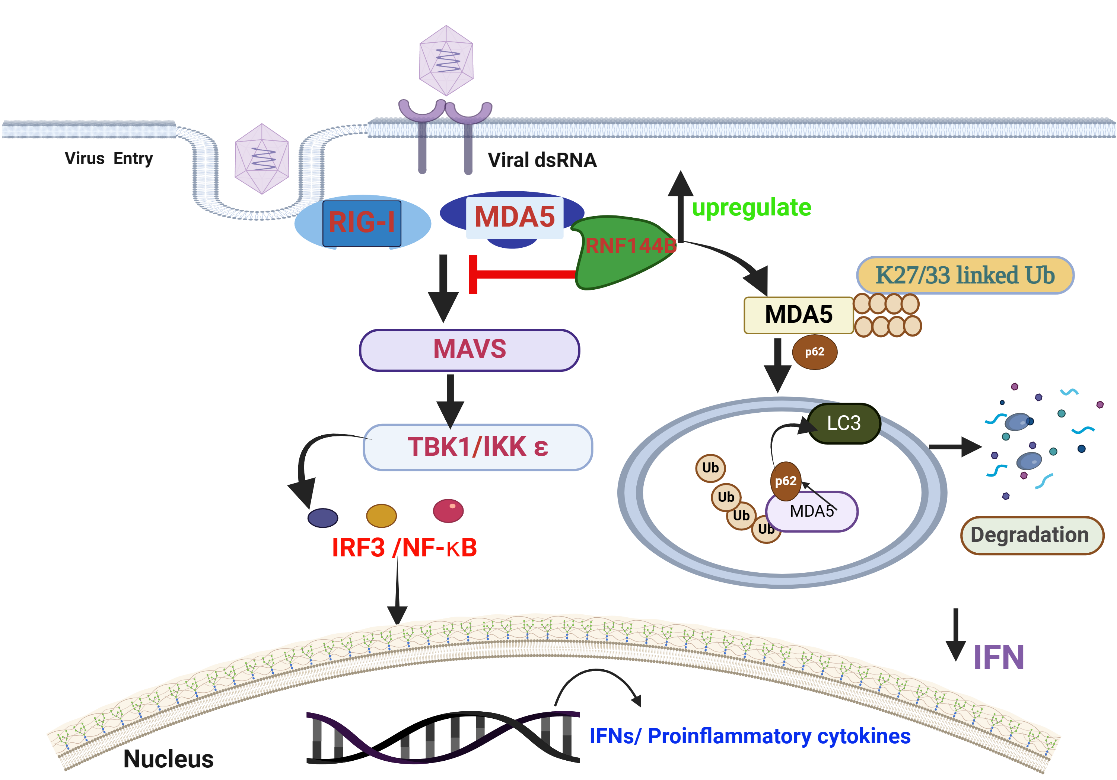
在机体复杂的天然免疫网络中,RLR(视黄酸诱导基因I样受体)信号通路扮演着抵御RNA病毒感染的关键角色。其中,RIG-I与MDA5作为模式识别受体,能够敏锐地识别病毒核酸,进而激活下游信号级联反应,诱导I型干扰素及促炎性因子的产生,构筑起抗病毒的第一道防线。然而,这一过程的平衡至关重要,因为RIG-I与MDA5的过度活化也可能触发自身免疫反应,对机体造成损害。
泛素化作为一种重要的蛋白质翻译后修饰方式,在精细调控RIG-I与MDA5活性方面发挥着不可或缺的作用。尽管已有研究揭示了部分E3泛素连接酶对这两者的调控,是否存在其他E3泛素连接酶调控RLR信号通路,仍待进一步探索。
该研究通过对感染猪繁殖与呼吸综合征病毒、口蹄疫病毒及塞内卡病毒的宿主细胞进行RNA-seq分析,发现RNF144B在病毒感染后显著上调表达。进一步的功能验证实验表明,RNF144B的过表达促进了EMCV(脑心肌炎病毒)的复制,而敲降其表达则显著抑制了病毒复制。在小鼠模型中,Rnf144b敲除小鼠的心脏与大脑中EMCV的复制水平远低于野生型小鼠,同时伴随IFN-β、IL-6与TNF-α等细胞因子mRNA表达水平的显著上升,且小鼠存活率更高。这些结果有力地证明了RNF144B在抗病毒免疫反应中的负调控作用。
为了深入解析RNF144B的作用机制,研究人员利用Co-IP及GST-pull down实验验证了RNF144B与MDA5之间的直接相互作用,并通过体内泛素化实验揭示了RNF144B能够催化MDA5的第23和第43位赖氨酸发生K27、K33位连接的多聚泛素化修饰。进一步的研究发现,将RNF144B的关键半胱氨酸位点(第48位、80位与219位)突变后,MDA5的泛素化水平显著降低,说明这些位点对RNF144B的催化活性至关重要。
此外,该研究还揭示了RNF144B通过自噬途径促进MDA5降解的具体路径。使用蛋白酶抑制剂MG132、自噬抑制剂CQ和凋亡抑制剂Z-VAD处理细胞后,发现RNF144B介导的MDA5降解依赖于自噬过程。进一步的研究表明,MDA5与自噬受体p62存在相互作用,且p62能够识别并促进K27和K33位修饰的MDA5通过自噬途径降解。
兰州大学卢曾军教授,兰州兽医研究所张婧博士,东北农业大学唐丽杰教授为本文的共同通讯作者。兰州兽医研究所/东北农业大学联合培养博士生李国秀,兰州兽医研究所张婧博士为本文的共同第一作者。该研究受到国家自然科学基金和中国农业科学院创新工程等项目资助。

