肖书奇教授团队揭示猪繁殖与呼吸综合征病毒感染导致细菌继发感染的关键分子机制
近日,学院肖书奇教授团队在《mBio》发表题为“PRRSV promotes bacterial infection by remodeling actin cytoskeleton and cell membrane proteins”的研究论文,研究揭示了猪繁殖与呼吸综合征病毒(PRRSV)感染容易导致细菌继发感染的关键分子机制,该研究为解决病毒感染后细菌继发感染这一防治难题提供了新的防控思路和靶点。
继发感染是病毒感染防控中的一个世界性难题。由PRRSV感染引发的继发细菌感染给畜牧业造成巨大经济损失,然而其相关机制一直不够明确。该研究发现,在PRRSV感染后的仔猪肺脏和肺泡巨噬细胞(PRRSV感染的靶细胞)中,肺炎克雷伯菌或链球菌2型的感染水平均显著高于对照组,且表现出更严重的临床症状、肺脏病理损伤和更高的仔猪病死率。
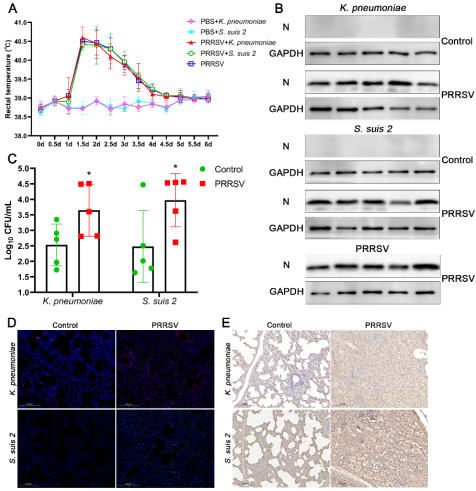
图1 PRRSV感染显著增加了仔猪肺脏的细菌负荷
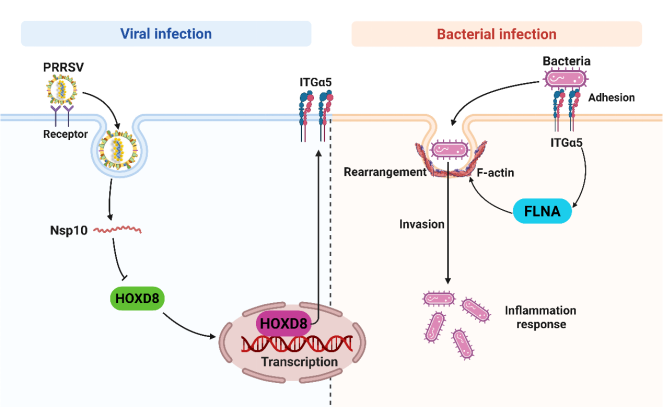
通过转录组学分析发现PRRSV感染显著改变了细胞骨架相关蛋白的表达谱,其中肌动蛋白结合蛋白FLNA的表达量显著上调。机制研究表明,FLNA通过促进F-actin的生成,驱动肌动蛋白细胞骨架重排,从而促进了细菌的入侵。进一步研究发现,PRRSV通过上调细胞膜蛋白整合素(ITGα5)的表达来增加细菌黏附,并且ITGα5还可通过促进FLNA表达,诱导肌动蛋白细胞骨架重排,来加剧细菌侵袭。值得注意的是,慢病毒shRNA介导的FLNA或ITGα5敲低小鼠感染实验显示,FLNA或ITGα5的敲低可显著降低小鼠肺部的细菌负荷,并有效降低小鼠的病死率。
该项研究表明,病毒重塑肌动蛋白细胞骨架可能是病毒诱导细菌继发感染的一种保守机制。该研究不仅揭示了PRRSV促进细菌继发感染的分子机制,也为开发针对病毒性继发感染的新型治疗策略提供了重要的靶点。
该研究得到国家重点研发计划、国家自然科学基金、甘肃省联合基金、甘肃省重大科技专项、中国农业科学院科技创新工程等项目的资助。肖书奇教授为本文通讯作者,刘霄博士为第一作者,硕士生吕方为共同第一作者。

