学院首批“萃英博士后”全部获批中国博士后科学基金第72批面上资助
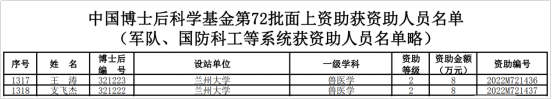
近日,中国博士后科学基金会发布通知,公布了中国博士后科学基金第72批面上资助人员名单。动物医学与生物安全学院首批“萃英博士后”王涛、支飞杰全部获得二等资助。
动物医学与生物安全学院高度重视人才队伍建设,加大博士后特别是“萃英博士后”引进力度,由专人负责引进人才的全过程、全方位对接,为进站博士后创造良好的工作、生活条件。2022年学院分两批共进站“萃英博士后”4名,普通博士后1名。
新闻背景:
“萃英博士后”王涛简介:
主要从事猪瘟病毒的复制组装、胞内转运和细胞间传播等相关研究,攻读博士学位期间,主要获得了以下研究进展:(1)发现CSFV通过自噬源细胞外囊泡在细胞间进行抗体抵抗性传播;(2)发现CSFV通过Rab22-Rab5-NS4B级联入侵PK-15细胞;(3)揭示了COPⅠ囊泡介导的胆固醇转运调控CSFV入侵的机制。迄今,以第一作者或通讯作者在《Autophagy》、《Veterinary Microbiology》期刊发表论文3篇,以并列第一作者在《Journal of Virology》、《Veterinary Microbiology》发表论文2篇,获“国家奖学金”等奖励。
项目名称:
内质网自噬在猪瘟病毒胞内转运中的作用及分子机制
项目简介:
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的严重影响全世界养猪业的烈性传染病。目前,CSFV隐性感染和持续性感染是我国猪瘟根除的最大阻碍,发现和揭示CSFV持续性感染的机制是探索猪瘟防控新方法的重要基础。近年来研究发现,病毒在宿主细胞内转运的过程中可以利用生物膜逃避免疫系统的监视和攻击,因此全面理解病毒的胞内转运路径有助于探究病毒持续性感染机制。该项目在前期工作的基础上,以CSFV感染后诱导的内质网自噬为研究对象,分析其在CSFV胞内转运中的作用,揭示CSFV利用内质网自噬机制转运的分子机理。研究结果将为深入理解CSFV胞内转运机制提供新的理论基础,并为开发针对CSFV的有效疫苗和抗病毒药物提供靶点。
“萃英博士后”支飞杰简介:
研究方向为布鲁氏菌毒力因子与致病机制解析、布鲁氏菌新型标记疫苗研发。筛选布鲁氏菌毒力因子,通过基因工程、分子生物学和多组学联合分析等试验技术和方法,解析其在布鲁氏菌毒力中的作用及其免疫保护性评价,深入揭示布鲁氏菌逃避宿主免疫防御的分子机制,为布鲁氏菌病的防控和新型疫苗的研发提供新靶点;参与“十三五”国家重点研发计划、国家自然基金面上项目和青年项目等;以第一作者在《International journal of molecular sciences》和《Journal of microbiology》等期刊发表论文五篇,揭示布鲁氏菌相关毒力因子的致病机制及其操纵宿主相关信号通路逃避宿主杀伤。
项目名称:
布鲁氏菌ArsR2蛋白介导铜解毒调控细菌毒力的分子机制
项目简介:
内布鲁氏菌病(简称布病)是由布鲁氏菌(Brucella)引起的严重威胁人类和动物健康的人兽共患病。布病在世界范围内广泛存在和流行,引起患病动物的不育、流产或产死胎等症状,造成严重的经济损失。布病难以防控的根本原因是布鲁氏菌通过表达或分泌多种毒力因子逃避宿主免疫防御机制,形成“隐匿性”感染策略,从而在宿主体内建立长期的持续性感染。揭示布鲁氏菌毒力因子逃避宿主免疫防御的机制是布病防控的关键,也是该领域研究的核心科学问题。
近年来,研究发现多种原核生物转录调控因子与细菌的致病性密切相关,其中最为重要的是ArsR转录调控因子家族成员,其主要作为金属转运蛋白和转录调控因子发挥维持胞内金属离子稳态,参与应激反应、鞭毛形成、代谢反应和毒力等。病原菌感染宿主过程中,铜离子在感染的部位逐渐积累,经巨噬细胞铜转运系统转运至吞噬溶酶体内发挥杀菌作用。然而,病原菌具有铜解毒机制来对抗宿主铜杀伤的作用。已有研究结果表明结核分枝杆菌铜解毒作用对其逃避宿主免疫防御机制以及成功建立感染必不可少。本项目从铜解毒角度解析ArsR2调控布鲁氏菌毒力的分子机制及其在逃避宿主铜杀伤中的作用,为深入解析布鲁氏菌逃避宿主免疫防御机制及其感染的“隐秘性”提供理论依据,为布病防控和疫苗研发提供新靶点。

